Вакцины: нужно ли бояться прививок
Микробиолог Денис Логунов о первых в
мире вакцинах, генно-инженерных технологиях в
современной вакцинной индустрии и перспективах лечения
рака...
***
Денис Логунов, доктор биологических
наук, заместитель директора НИИ эпидемиологии и
микробиологии имени Н.Ф. Гамалеи, член-корреспондент РАН
***
Вакцины - это специально разработанные
препараты для формирования иммунитета к определенным
вирусам или микроорганизмам. Первые вакцины состояли из
ослабленных или убитых возбудителей. Например, вакцина
от оспы содержала живой вирус коровьей оспы, полученный
из пустул инфицированных животных. Он изначально хуже
приспособлен к условиям организма человека: может
ограниченно размножаться, но не способен вызвать
полноценную инфекцию. Для приготовления вакцины против
бешенства вирус пассировали на грызунах или кроликах, а
затем высушивали инфицированные вирусом мозги над
щелоком и использовали для вакцинации.
История вакцинации
На протяжении истории подходы к
вакцинации неоднократно менялись. Первые попытки
предотвратить инфекцию были связаны с процедурой
вариоляции: у больных оспой брали гнойное содержимое
пустул и вводили здоровым. Это с современных позиций
была чудовищная процедура: от 1,5 до 8% прошедших через
нее людей погибали или тяжело заболевали, но в случае
заражения оспой вероятность смерти была еще выше -
20–30%.
Первую вакцину создал английский врач
Эдвард Дженнер в 1796 году. Его решение о разработке
профилактического препарата против оспы базировалось на
наблюдении английских медиков, которые за тридцать лет
до Дженнера обнаружили, что кавалеристы и доярки,
переболевшие коровьей оспой, не заболевают человеческой
оспой, однако английское научное сообщество отвергло это
открытие. Дженнеру первым удалось публично доказать, что
обнаруженный феномен реален. Он взял мальчика из
сиротского приюта и вакцинировал его содержимым коровьей
пустулы. Через несколько недель он взял пустулу от
человека, больного черной оспой, и заразил мальчика. Тот
впоследствии не заболел. Вакцинация против натуральной
(или, по-другому, черной) оспы штаммом коровьей оспы
вошла в практику, а вариоляцию постепенно запретили.
Отсюда же в практику вошло слово "вакцина" (от лат. vaccina -
"коровья").
Вторую вакцину - от бешенства -
разработал Луи Пастер почти век спустя, в 1885 году. В
отличие от вакцины против оспы, она вводилась уже после
попадания вируса в организм, после укуса человека
бешеным животным. История внедрения этой вакцины в
медицинскую практику является ярким примером борьбы со
скептическим отношением общества к вакцинам. Несмотря на
шумный успех в начале (когда был спасен мальчик,
покусанный бешеной собакой), дела у Пастера шли не
слишком гладко, потому что часть укушенных людей часто
доезжала до его антирабической (от лат. rabies -
"бешенство") станции в Париже слишком поздно. Позднее
Николай Федорович Гамалея установил, что с момента
заражения бешенством должно пройти не больше 14 дней,
иначе вакцинация становится неэффективной. Ему совместно
с Ильей Ильичом Мечниковым удалось убедить Пастера
открыть в 1886 году вторую в мире антирабическую станцию
в Одессе. Эффективная работа этой станции позволила
менее чем за год накопить достаточно доказательств
эффективности вакцины и внести существенный вклад в ее
повсеместное признание.
***
Читайте также по теме:
***
Вакцины против самых важных инфекций,
уносивших огромное количество жизней, - брюшного тифа,
холеры, чумы - были разработаны еще до Первой мировой
войны в институте Пастера его учениками.
Важным прорывом в производстве вакцин
стала разработка методов культивирования вирусов в
куриных эмбрионах и потом в культурах клеток. Таким
образом было получено сразу несколько вакцинных
препаратов против гриппа, кори, краснухи, эпидемического
паротита, клещевого энцефалита и других.
Следующей важной вехой в развитии
технологий получения профилактических препаратов стало
появление генно-инженерных вакцин. Прорыв был совершен
благодаря сразу трем нобелевским открытиям: расшифровке
генетического кода (1968), открытию рестриктаз (1978) и
разработке метода секвенирования ДНК (1980). С этого
момента у человечества появилась возможность делать
генно-инженерные продукты. Сразу последовал прогресс в
разработке вакцин, была получена вакцина против гепатита
В. Гликопротеин оболочки вируса гепатита В, который
используется в качестве протективного антигена,
нарабатывают в культуре дрожжевых клеток, в которые
искусственно введена генно-инженерная конструкция,
несущая ген данного антигена.
В настоящее время процесс получения
генно-инженерных вакцин продолжает развиваться и
усложняться.
Виды вакцин
Во время вакцинации в организм вводят
либо сам патоген (вирионы или микробные клетки), либо
его фрагменты. Вакцины, содержащие цельный патоген,
бывают аттенуированными (от лат. attenuatio -
"ослабление"), то есть с ослабленным возбудителем, и
инактивированными - с убитым возбудителем. Например,
российская вакцина от полиомиелита является
аттенуированной, а американцы используют
инактивированную вакцину.
Субъединичные и расщепленные вакцины
содержат фрагменты патогена. Фрагментом может быть,
например, токсин, как в случае дифтерии и столбняка, или
полисахаридная капсула возбудителя, как в случае вакцины
против менингита. Иногда полисахариды патогена химически
сшивают (конъюгируют) с поверхностью белка-носителя
(пневмококковая вакцина), чтобы повысить их
иммуногенность и протективность.
Сегодня продолжаются и интенсифицируются
разработки вакцин с использованием генно-инженерных
методов. Большое внимание уделяется созданию ДНК-вакцин
и векторных вакцин. В ДНК-вакцинах фрагменты генома
патогена помещены в плазмиды - кольцевые молекулы ДНК,
которые встречаются у бактерий. После введения такой
вакцины в организм генетический материал патогена
экспрессируется в клетках привитого организма - клетки
начинают самостоятельно синтезировать протективные
антигены патогена. В ответ на появляющийся в организме
чужеродный антиген реагирует иммунная система. Вирусные
векторные вакцины работают по такому же принципу, но для
доставки генетического материала патогена в клетки
используются не плазмиды, а вирусные векторы -
обезвреженные вирусы, у которых удалены области генома,
ответственные за патогенность и размножение.
Важное место в разработке вакцин
занимает подход, называющийся "обратная генетика". Это
направленное изменение генов с целью получения
определенных признаков (прямой генетикой называется
противоположный подход, при котором анализируют признаки
и на основе этого пытаются что-то понять о генах). При
помощи метода обратной генетики сегодня создаются,
например, гриппозные вакцины. Измененные
генно-инженерным способом сегменты генома вируса гриппа
содержатся в восьми плазмидах. Используя такие плазмиды,
в культуре клеток можно получать безопасные
холодоадаптированные вакцинные штаммы вируса.
Содержащиеся в плазмидах сегменты генома вируса,
кодирующие в том числе протективные антигены -
гемагглютинин и нейраминидазу, можно модифицировать
методами генной инженерии таким образом, чтобы в
безопасном вакцинном штамме появились протективные
антигены, свойственные для актуальных (патогенных)
штаммов вируса гриппа. Для получения вакцинного штамма
модифицированные плазмиды вводят в культуру клеток,
"оживляют" новый вакцинный штамм и нарабатывают его в
промышленном масштабе, в основном в куриных эмбрионах.
Наработанные таким образом вакцинные штаммы используют
для вакцинации либо в качестве "живой" аттенуированной
вакцины, либо в разрушенном виде - как "расщепленную"
вакцину.
Следует отметить, что генно-инженерные
методы ни в коем случае не заменяют традиционные методы
получения вакцин, а привносят новые возможности. Есть
много непобежденных особо опасных инфекций, против
которых успешно разрабатывают как инактивированные, так
и генно-инженерные вакцины, например флави-, фило-,
буньявирусные и другие инфекции.
Существует также класс синтетических
вакцин, которые представляют собой искусственно
синтезированные пептиды, имитирующие небольшие участки
антигенов возбудителя. Однако укладка полипептидных
цепей целого антигена существенно отличается от укладки
коротких фрагментов, поэтому добиться эффективной
стимуляции гуморального иммунитета с помощью
синтетических вакцин довольно сложно. Синтетические
полипептиды могут стимулировать незначительный клеточный
иммунитет, но и в этом случае ответ получается
значительно слабее, чем при использовании полноразмерных
антигенов.
Вакцины и иммунная система
Ответ организма на инфекцию бывает
разным. Если нужно нейтрализовать внеклеточный патоген,
например бактерию, В-лимфоциты (плазмоциты) вырабатывают
антитела. Такой иммунитет называется гуморальным (от
лат. humor - "жидкость"), поскольку молекулы, которые
выполняют защитную функцию, растворены в плазме крови.
Если же нужно убить клетку собственного организма, в
которой находится вирус или неоантиген (антиген раковой
опухоли), работает клеточный иммунитет, основой которого
является активность Т-лимфоцитов.
Поскольку на формирование иммунитета
требуется время, вакцины вводятся в организм, как
правило, заблаговременно, но бывают и исключения,
например вакцина от бешенства. Антитела появляются в
организме на 10–14-й день после введения вакцины от
бешенства, но за счет относительно длительного
инкубационного периода заболевания вакцина успевает
сработать. При этом не стоит путать вакцину против
бешенства с антирабическим иммуноглобулином
(сывороткой). Сыворотка содержит уже готовые
антирабические антитела (в России используют антитела
лошади) и вводится параллельно с вакциной в тяжелых
случаях, например если укусы расположены близко к
голове.
Различные по своей природе вакцины могут
стимулировать различный иммунный ответ. Субъединичные и
расщепленные вакцины индуцируют хороший гуморальный и
Т-хелперный иммунитет. Последний помогает В-лимфоцитам
размножаться и продуцировать антитела. Живые вирусные и
векторные вакцины стимулируют хороший Т-киллерный
иммунитет, который при этом может иметь подавляющий вес,
а может развиваться параллельно с гуморальным
иммунитетом.
При создании новых вакцин следует
учитывать данные о том, какой тип иммунитета необходимо
сформировать в организме, для того чтобы защититься от
конкретного типа возбудителя, и с учетом этих данных
приступать к выбору стратегии создания вакцины.
Трудности при разработке вакцин
Одной из главных проблем при создании
вакцин является изменчивость патогенов. Самым известным
примером является вирус иммунодефицита человека. ВИЧ -
это ретровирус. Попадая в клетку, он переводит свою
геномную РНК в ДНК посредством обратной транскрипции и
встраивает ее в ДНК клетки. Обратная транскриптаза
крайне "неаккуратный" фермент, который делает много
ошибок, в результате чего в организме при каждом цикле
размножения формируется значительное количество
мутантных (измененных) форм вируса, против которых наш
иммунитет, сформированный на предыдущем этапе, является
неэффективным. То есть создается ситуация, когда
иммунитет постоянно не успевает за изменяющимся вирусом.
Другой проблемой является низкая
иммуногенность антигенов в инактивированном, например,
формальдегидом возбудителе. Это наряду с невозможностью
получить аттенуированную форму возбудителя (большинство
возбудителей особо опасных инфекций) значительно
затрудняет процесс получения вакцин.
Крайне трудно разработать вакцину против
возбудителей, имеющих сложный жизненный цикл. Например,
малярийный плазмодий за свой жизненный цикл сменяет
несколько форм, которые очень отличаются друг от друга
по строению и антигенному составу. Идентифицировать
протективные антигены в этих формах или в какой-то из
них и индуцировать устойчивый защитный иммунный ответ до
сих пор не удается.
Иногда сложность при создании вакцины
заключается в стратегии выживания патогена. Например, он
может прятаться внутри клеток и убирать с их поверхности
молекулы, ответственные за презентацию антигенов
иммунным клеткам, тем самым становясь незаметным для уже
сформированных в организме иммунных клеток (Т-клеток).
С проблемой блокировки Т-клеточного
иммунитета ученые столкнулись при разработке не только
противоинфекционных вакцин, но и вакцин от рака. Первые
попытки создания противораковых вакцин были связаны с
появлением методов выделения и накопления дендритных
клеток и Т-киллеров в больших количествах. Т-киллеры
стали выращивать в лабораторных условиях в присутствии
опухолевых клеток, тем самым обучая их распознавать
опухолевый антиген. В организм вводили такие обученные
Т-киллеры либо дендритные клетки, нагруженные
опухолевыми антигенами, чтобы специфические Т-лимфоциты
созревали в организме. Но даже если вначале наблюдалась
регрессия опухоли, вскоре она возвращалась. Было
абсолютно непонятно почему. Ведь иммунитет потенциально
может "выжечь" абсолютно все. Например, если формируется
аутоиммунный процесс, человек может остаться без органа,
к которому сформировался аутоиммунитет.
Оказалось, что опухолевые клетки умеют
целенаправленно блокировать иммунный ответ в опухолевом
очаге. В организме есть Т-регуляторные клетки, которые
предотвращают развитие аутоиммунитета. Как только против
собственных клеток развивается избыточный иммунитет,
Т-регуляторные клетки соединяются определенными
молекулами с рецепторами на Т-лимфоцитах и выключают их
активность. Опухолевые клетки тоже умеют экспрессировать
на своей поверхности такие молекулы. Получается, с
собственным иммунитетом борются одновременно
Т-регуляторные клетки и опухолевые клетки, и в таких
условиях победить опухоль очень сложно.
Решение пришло, когда были обнаружены
два ключевых рецептора: CTLA-4 и PD-1. Было показано,
что введение в организм антител против них или против их
лигандов пробуждает Т-лимфоциты и стимулирует
противоопухолевый иммунитет (1994). Сегодня при
некоторых типах рака достаточно введения таких антител
без всякой химиотерапии для устойчивого увеличения
показателя трехлетней выживаемости.
Успехи в борьбе со злокачественными
новообразованиями еще раз подчеркивают тот факт, что для
разработки эффективных вакцин необходимо детально
понимать не только механизмы формирования иммунитета, но
и механизмы взаимодействия конкретного патогена с
иммунной системой человека.
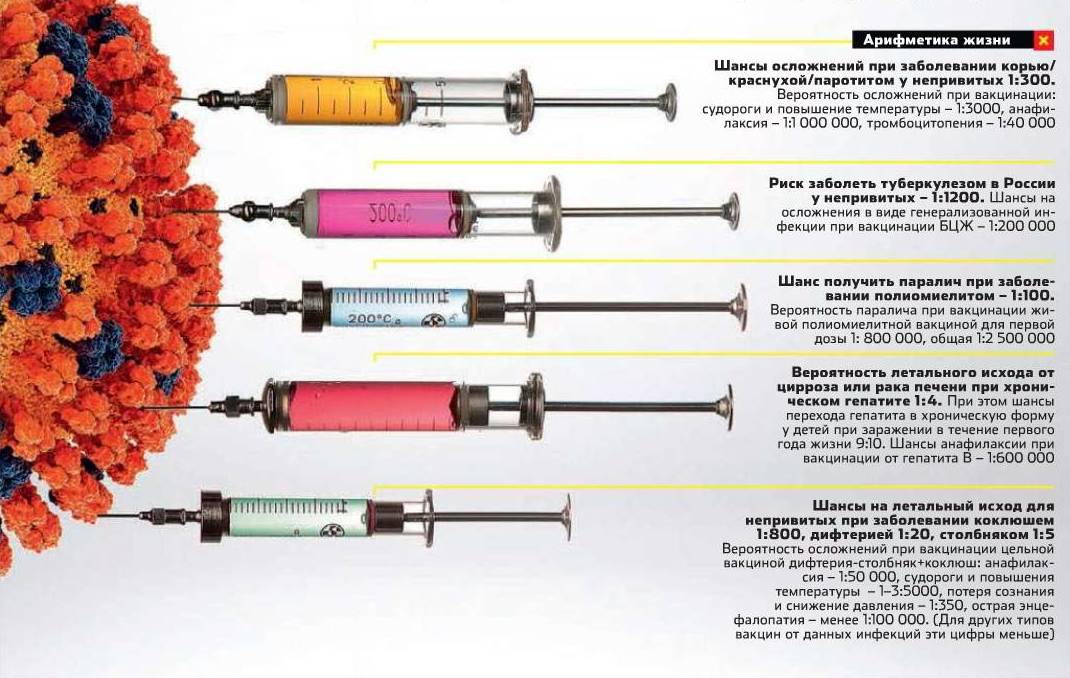
Эффективность вакцин: безопасность
прививок
Согласно оценкам ВОЗ, только от кори
вакцинация ежегодно спасает 2,6 миллиона жизней. С
момента введения ВОЗ "Расширенной программы по
иммунизации" в 1974 году было предотвращено около 115
миллионов смертей от кори - эта цифра приближается к
населению нашей страны. Если учитывать инвалидизацию и
отдаленные последствия болезни, цифры будут еще более
ошеломляющими.
Массовая вакцинация ликвидирует
"субстрат" для формирования очагов эпидемии. Дети
антипрививочников не заболевают благодаря тому, что
другие родители вакцинируют своих детей. Когда
антипрививочные настроения начинают перевешивать и
уровень вакцинации падает, вспышки заболеваний не
заставляют себя ждать - примерами служат периодические
вспышки инфекций (например, кори, полиомиелита) в
странах, где охват вакцинации является недостаточным.
При этом антипрививочники не являются
абсолютным злом, у них есть полезная функция: их
постоянная настороженность и критика увеличивают
ответственность производителей, потому что любая
оплошность чревата большим скандалом. Однако
аргументация современных антипрививочников звучит для
специалистов так же нелепо, как опасения современников
Дженнера: когда Дженнер стал прививать людей коровьей
оспой, противники вакцинации утверждали, что тот, кто
будет прививаться, станет наполовину коровой.
Международные стандарты предъявляют
высочайшие требования к безопасности вакцин, даже
большие, чем к терапевтическим препаратам. При простом
переносе производственной площадки, выпускающей уже
зарегистрированную вакцину, все доклинические и
клинические исследования должны проводиться заново в
полном объеме. Для сравнения: если вы переносите
производство химического препарата, то вам нужно
показать только биоэквивалентность - соответствие
производимого лекарственного препарата оригинальному.
В мифах про токсичные уровни ртути и
алюминия в вакцинах, про корреляцию вакцинации с
аутизмом научная составляющая отсутствует. Исследования
показали, что никакой статистически достоверной связи
между вакцинацией и отрицательными явлениями, которые
связаны с ней в умах антипрививочников, в реальности
нет. Авторы работы, в которой якобы нашли связь с
аутизмом, были уличены в фальсификации данных.
Применение вакцин, хоть и в крайне
низкой степени, все же сопряжено с определенными
побочными эффектами и реактогенностью. По каждой вакцине
ВОЗ открыто публикует статистику легких, средних и
тяжелых нежелательных явлений. Все существующие прививки
вне зависимости от того, включены они в национальный
календарь прививок или в календарь прививок по
эпидпоказаниям, применяются с четкой оценкой показателя
"польза - риск".
Денис Логунов
Постнаука - 10.12.2018.
|

